
GHS pictograms (GHS: International Globally Harmonized System of Classification and Labelling of Chemicals)
GHS signal word (Danger or Warning)

….(TWA) TWA: Time weighted average …(STEL) STEL: Short Term Exposure Limit
LD50 (median dose)
LC50 (median concentration)
LCLo (lowest published)
بررسی مهم
- نوع محصول : مایع
- قابلیت اشتعال: ندارد
- خطر مرگ : کم
ثبت سفارش و صدور پیش فاکتور
راهنمای ثبت سفارشبا تشکر از شما ثبت سفارش با موفقیت انجام شد
برای پیگیری وضعیت سفارش و پرینت پیش فاکــــتور صـــادر شده لطفا کد رهــگیری فوق را یاداشت نمایید.
با استفاده از کد رهگیری می توانید:
- سفارش خود را کنسل کنید
- وضعیت سفارش خود بررسی نمایید.
- پیش فاکتور موقت و یا فاکتور نهایی آنلاین را دریافت نمایید.
توضیحات عمومی |
|
خصوصیات فیزیکی شیمیایی سولفوريك اسيد |
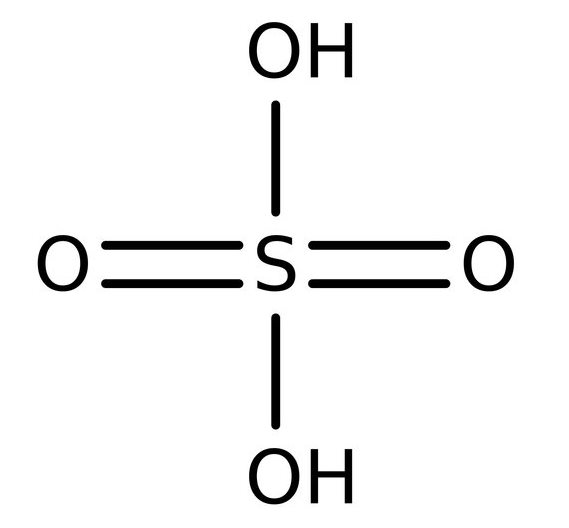
رنگ، بو، حالت فیزیکی و خصوصیات فیزیکی معروف:سولفوریک اسید یک سولفور اوکسواسید[۲] ( و یا به عبارتی یک یون چند اتمی[۳] ) مشتق شده از هیدروژن سولفات است که شامل دو اوکسو و دو گروه هیدروکسی است که به یک اتم گوگرد مرکزی متصل شده اند و عمدتا در واکنش ها نقش کاتالیست را دارد. این ماده یک مایع شفاف، بی رنگ و یا گاها قهوه ای رنگ، بی بو، روغنی، خورنده پارچه و فلزات، … بوده که در صورت تماس با چوب، کاغذ، گلوکز و برخی از مواد کربن دار سبب نیم سوز شدن آن ها می شود. با استفاده از ترکیباتی مانند مولیبدنیوم[۴]، کروم[۵] و سیلیکون[۶] می توان مقاومت این ماده در برابر خوردگی را افزایش داد چرا که میزان خوردگی آن به شدت وابسته به دما، غلظت، اسیدی بودن[۷] و ناخالصی های موجود در آن است. این ماده به شدت خورنده می تواند در باران هاي اسيدي سبب از بین بردن رنگ و نابودی سنگ آهک، سنگ مرمر و کاشی های مورد استفاده در نمای پشت بام[۸]، افزایش شکنندگی کاغذ، کاهش مقاومت چرم و زدودن رنگ از روی سطوح رنگ شده شود. در صورت حرارت دیدن شکل خالص آن، به آب و گوگرد سه اکسید[۹] تجزیه می شود. در محلول های آبی نیز به راحتی یونیزه شده و یون های هیدرونیوم (+H3O) و هیدروژن سولفات (HSO4–) تشکیل می شوند. در محلول های بسیار رقیق نیز امکان تجزیه ی هیدروژن سولفات به هیدرونیوم و یون های سولفات (SO4-2) وجود دارد. حلالیت سولفوريك اسيد در حلالها و آب: انحلال پذیر در آب،انحلال پذیر در الکل ها مانند اتانول که با آزاد کردن گرما و افزایش حجم همراه است. |
شرکتهای تولیدکننده سولفوريك اسيد |
| تولیدکنندگان ایرانی:
در حال حاضر ۲۱ شرکت خصوصی از تولیدکنندگان سولفوريك اسيد هستند. |
| تولیدکنندگان خارجی:
چین، انگلستان، ژاپن ، تایلند، اوکراین، پاکستان، فیلیپین، روسیه، آلمان، هند، عربستان، امارات، آمریکا، بلژیک، فنلاند، فرانسه، ایتالیا، اسپانیا، یونان |
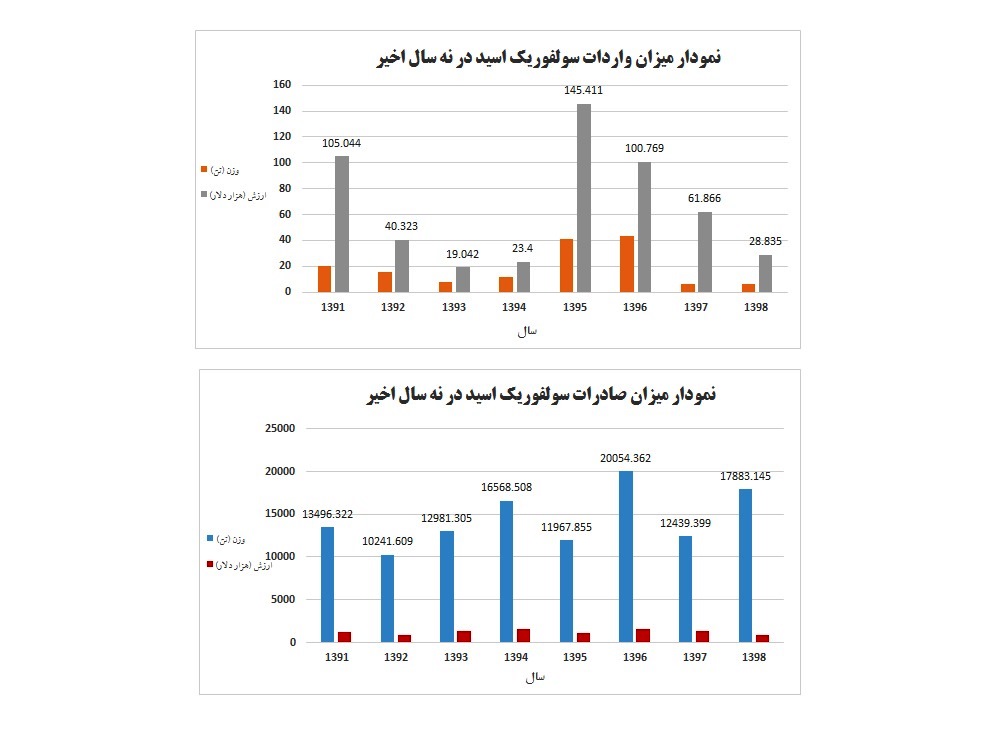
ميزان واردات و صادرات سولفوريك اسيد (كد تعرفه گمركي ۲۸۰۷۰۰۰۰)؛ |
|
|
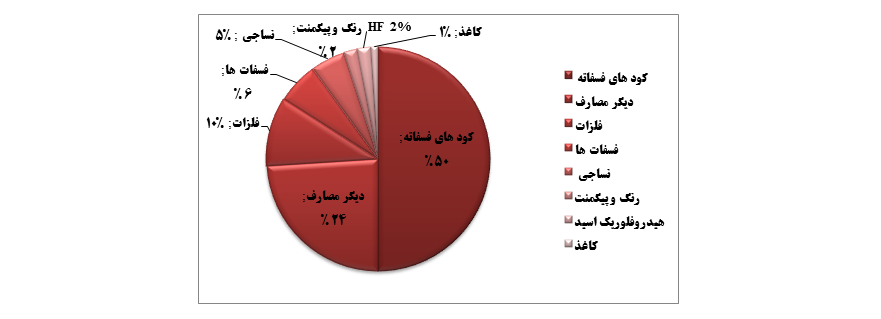
کاربردهای سولفوريك اسيد |
صنایع مصرف کننده سولفوريك اسيد به ترتیب میزان مصرف:۱) صنعت تولید باتری : در تولید باتری های اسیدی که در خودروها مورد استفاده هستند، از آن به عنوان الکترولیت استفاده می شود. این باتری ها عمدتا حاوی ۳۵% سولفوریک اسید هستند. ۲) صنایع شیمیایی : ترکیبی از سولفوریک اسید و سولفور تری اکسید ( و یا گاها دی سولفوریک اسید ) که اولئوم[۱۰] نام دارد در آماده سازی ترکیبات آلی استفاده می شود. با واکنش فلئوریت ( CaF2 )[11] و اسید سولفوریک، هیدروژن فلوراید و کلسیم سولفات تولید می شوند که از هیدروژن فلوراید برای تولید محلول های آبی اسید هیدروفلوئوریک استفاده می شود. از دیگر کاربردهای این اسید، رطوبت گیری از کلر است. از دیگر کاربردهای آن تولید هیدروکلریک اسید، نیتریک اسید، فسفریک اسید، کلسیم دی هیدروژن فسفات، نمک های سولفات، سوپر فسفات، آمونیوم سولفات و آلومینیوم سولفات است. همچنين اسيد سولفوريك به عنوان كاتاليزور در بسياري از واكنش هاي شيميايي همچون استريفيكيشن و آلكيلاسيون و همچنين به عنوان عامل موثر در تنظيم PH مورد استفاده قرار مي گرد. ۳) صنایع کشاورزی : بیش از نیمی از مصرف سولفوریک اسید مربوط به استفاده از آن در تولید سوپر فسفات است که برای تولید کود استفاده می شوند. در این فرآیند از این سولفوريك اسيد به منظور اسیدی کردن سنگ فسفات استفاده می شود. ۲Ca5(PO4)3F + 7H2SO4 + 3H2O → ۷CaSO4 + 3Ca(H2PO4)2.H2O + 2HF ۴) صنعت رنگ : یکی از ترکیبات برگرفته از سولفوریک اسید، تیتانیوم دی اکسید[۱۲] است که به عنوان رنگدانه رنگ سفید، رنگ دانه جوهر چاپ، پرکننده ی پلاستیک و کاغذ و به عنوان یک رنگ دهنده در صنایع غذایی کاربرد دارد. در فرآیند تولید تیتانیوم دی اکسید، ایلمنیت[۱۳] که یک ترکیب آهن/تیتانیوم اکسید[۱۴] معروف است به وسیله ی ۶۰% سولفوریک اسید اضافه و غلیظ در دمای c ˚ ۱۰۰ تصفیه شده و تیتانیوم اکسید سولفات[۱۵]، سولفات آهن و آب تولید می شوند. FeTiO3 + 2H2SO4 → FeSO4 + TiOSO4 + 2H2O در مرحله ی بعد به منظور جداسازی محصول اضافی( آهن دو سولفات )، محصول تا دمای c ˚ ۱۵ سرد شده و کریستال های آهن دو سولفات تشکیل می شوند. سپس به روش فیلتراسیون از محیط واکنش جداسازی می شوند. محصول آبی باقی مانده تا دمای c ˚ ۱۱۰ به منظور هیدرولیز تیتانیوم اکسید سولفات، حرارت داده می شود و واکنش زیر انجام می شود : TiOSO4 + (n+1)H2O → TiO2•nH2O + H2SO4 در این مرحله سولفوریک اسید و رسوب ژل تیتانیوم دی اکسید هیدراته تولید می شوند. در مرحله ی آخر تیتانیوم دی اکسید هیدراته در کوره های دوار بزرگ در بازه دمایی c ˚ ۳۰۰-۲۰۰ به منظور جداسازی آب و تشکیل کریستال های تیتانیوم دی اکسید حرارت داده می شوند. (Learn Chemistry) TiO2•nH2O → TiO2 + nH2O ۵) صنعت تولید الیاف مصنوعی : در تولید فیبرهای ریون یا ابریشم مصنوعی که از فیبرهای سلولزی تولید می شوند، از سولفوریک اسید به عنوان یک عامل احیاکننده استفاده می شود. (C6H9O4O−SC−SNa)n + 1/2nH2SO4 → (C6H10O5)n + nCS2 + 1/2nNa2SO4 ۶) صنعت نفت : در این صنعت برای تولید بنزین با اکتان بالا در واحد آلکیلاسیون به منظور آلکیل دار کردن آلکن ها از سولفوریک اسید به عنوان کاتالیست استفاده می شود. ۷) صنعت چوب : در تولید صفحات فشرده ی چوب مانند نئوپان از ترکیب چسب تانین-ساکاروز[۱۶] واسید سولفوریک به منظور بهبود فرآیند پخت استفاده می شود و اسید نقش کاتالیزور دارد. ۸) صنعت کاغذ : برای رنگ بری از خمیر کاغذ درختان کاج و راش از سولفوریک اسید رقیق با ۱ = PH، و مقادیری افزودنی سدیم نیترات و سدیم نیتریت استفاده می شود. ۹) صنایع فلزی : در این صنایع در تمیز کردن آهن و فولاد قبل از پوشاندن آن ها با قلع یا روی از سولفوريك اسيد استفاده می شود. سهم هر صنعت از مصرف این ماده چقدراست؟
|
فرايند توليد سولفوريك اسيد |
حجم تولید سالیانه این ماده در سالهای اخیر:در حال حاضر سولفوريك اسيد توسط ۲۱ شرکت داخلی به میزان ۷۹۴۰۰۰ تن تولید می شود. همچنين پتروشيمي رازي با ظرفيت ۱۱۷۵۳۰۰ در سال بزرگترين واحد توليد كننده سولفوريك اسيد در ايران است. روشهای مختلف تولید سولفوريك اسيد:۱) سولفوریک اسید برگرفته از سولفور ( اکسیداسیون کاتالیستی ) : این روش شامل چهار مرحله ی استخراج سولفور، تبدیل سولفور به سولفور دی اکسید، تبدیل سولفور دی اکسید به سولفور تری اکسید و در نهایت تولید اسید سولفوریک با استفاده از واکنش سولفور تری اکسید و آب است. مهم ترین منابع برای استخراج سولفور، سوخت های فسیلی مانند ذغال سنگ و گاز طبیعی و سولفید حاصل از پالایش فلزات برگرفته از سنگ های معدنی هستند. جهت تبدیل سولفور به سولفور دی اکسید ملاس گوگرد در کوره اسپری شده و در حضور هوای خشک و در دمای K 1300 سوزانده می شود. سپس سولفور دی اکسید تولید شده آبگیری شده ودر یک راکتور بستر ثابت ( دارای سه بستر ) در حضور کاتالیست وانادیوم پنتواکسید بر پایه ی سیلیکا[۱۷] به سولفور تری اکسید تبدیل می شود. ۲SO2 + O2 2SO3 ΔH = -46.3kcals در مرحله آخر سولفور تری اکسید به سولفوریک اسید تبدیل می شود. به این منظور ابتدا سولفورتری اکسید سرد شده و سپس از دو برج عبور داده می شود. ترکیب سولفوریک اسید رقیق شده با آب ( سولفوریک اسید ۹۸% ) و سولفور تری اکسید، منجر به جذب سولفور تری اکسید به وسیله ی اسید غلیظ شده و مایع فومی به نام اولئوم تشکیل می شود. در برج اول سولفور تری اکسید به وسیله ی اولئوم و در برج دوم توسط سولفوریک اسید رقیق شده شسته شده و واکنش سولفور تری اکسید با آب منجر به تولید سولفوریک اسید با غلظت بالاتر می شود. واکنش انجام شده مطابق زیر است : sulfur trioxide + water sulfuric acid SO3(g) + H2O(l) H2SO4(l) واکنش مابین سولفور تری اکسید و آب به شدت گرماده بوده و باعث تولید بخارات سولفوریک اسید می شود که کندانس کردن آن بسیار دشوار است. به همین دلیل امکان ترکیب کردن مستقیم سولفور تری اکسید و آب وجود ندارد.
۲) تولید سولفوریک اسید با استفاده از آمونیوم سولفات[۱۸] : آمونیوم سولفات یک محصول جانبی در تولید پلی ( متیل ۲- متیل پروپنوئات )[۱۹] است. حرارت دادن این ترکیب منجر به تولید آمونیاك[۲۰] و نمک های سولفات مانند نمک بی سولفات، پیروسولفات و ترکیبی از آن ها می شود. در این مرحله آمونیا جدا شده و به سولفات های نمک، آب افزوده می شود که سولفوریک اسید محصول آن است. در آخرین مرحله سولفوریک اسید از دیگر سولفات های نمکی جدا شده و به منبع ذخیره فرستاده می شود. |
نحوه بسته بندی و عرضه سولفوريك اسيد |
| سولفوريك اسيد در بشكه هاي پلي اتيلن ۳۸۰ كليوگرمي و بصورت فله در تانكر مخصوص حمل اسيد قابل عرضه است. |
فهرست واژگان
[۱]– hydrofluoric acid (HF)
[۲]– sulfur oxoacid : اکسی اسید یا اوکسو اسید به اسیدی گفته می شود که اتم اکسیژن در ساختار خود داشته و حداقل یک اتم هیدروژن به آن متصل شده باشد و بتواند به راحتی با گرفتن یک یا چند الکترون تشکیل آنیون دهد.
[۳]– Polyatomic ion : یون چند اتمی گونه ای از یون های شیمیایی است که حداقل از دو نوع اتم ساخته شده است.در این نوع یون ها که به یون های مولکولی نیز معروف هستند، اتم ها با پیوند های شیمیایی به هم پیوند دارند و کل مولکول بار مشخصی را خواهد داشت.
[۴]– molybdenum [5]– chromium [6]– silicon [7]– acid velocity [8]– roofing slate [9]– sulfur trioxide [10]– fuming sulfuric acid or oleum [11]– fluorspar or Fluorite [12]– titanium dioxide [13]– ilmenite (FeTiO3) [14]– iron/titanium oxide [15]– titanium oxygen sulphate ( TiOSO4) [16]– tannin-sucrose adhesive : چسب هایی که برای تولید مواد پایه بیولوژیکی ( عمدتا در چسباندن چوب و تولید نئوپان ) استفاده می شوند. [۱۷]– vanadium pentoxide on a silica [18]– ammonium sulfate [19]– poly(methyl 2-methylpropenoate) [20]– ammonia ( NH3 )

 نمودار شماره سه – نمودار میزان مصرف اسید سولفوریک به تفکیک صنایع
نمودار شماره سه – نمودار میزان مصرف اسید سولفوریک به تفکیک صنایع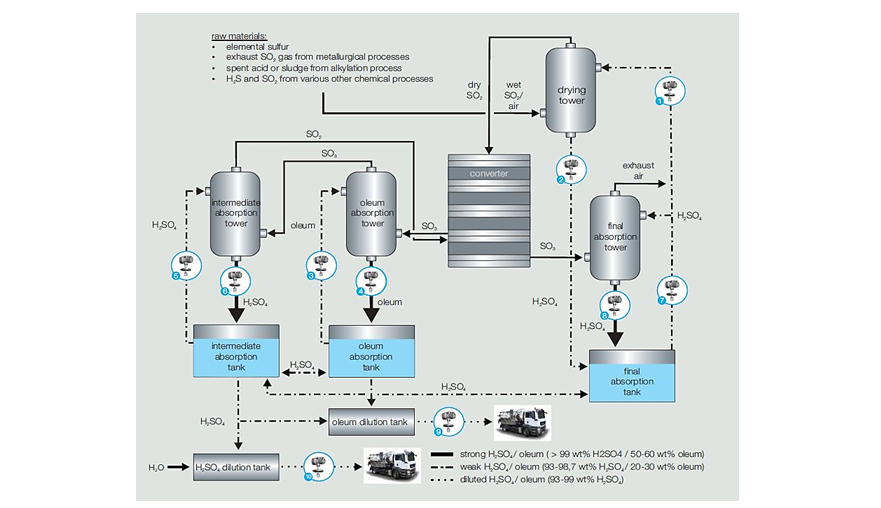 شکل شماره یک – فرآیند تولید اسید سولفوریک از سولفور دی اکسید (Senso Tech)
شکل شماره یک – فرآیند تولید اسید سولفوریک از سولفور دی اکسید (Senso Tech)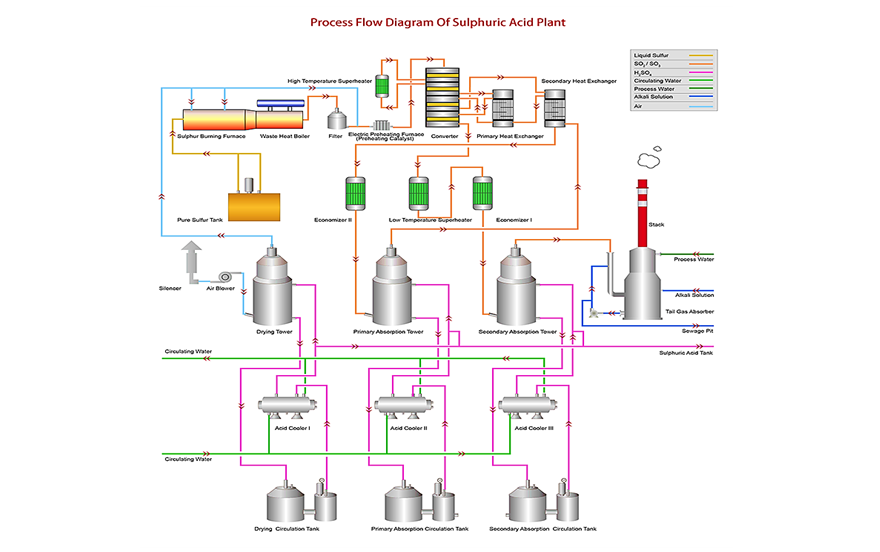 شكل شماره دو-PFD فرايند توليد سولفوريك اسيد از سولفور دي اكسيد
شكل شماره دو-PFD فرايند توليد سولفوريك اسيد از سولفور دي اكسيد